Abstrak
Aspirin bersifat antipiretik dan analgesik karena merupakan kelompok senyawa glikosida, aspirin yang merupakan nama lain dari asam asetil salisilat dapat disintesis dari asam salisilat, yaitu dengan mereaksikannya dengan anhidrida asetat, hal ini dilakukan pertama kali oleh Felix Hofmann dari perusahaan Bayer, Jerman. Karena saat itu antipiretik dan analgesik yang ada sangat keras terhadap sistem pencernaan. Pada percobaan ini diperoleh persen rendemen .
Dalam tablet aspirin komersil sering kali masih terdapat asam salisilat didalamnya, juga ada tablet yang kadar aspirinnya tidak memenuhi standar, karena itu perlu diuji kandungannya dengan uji FeCl3 dan diuji kadarnya dengan titrasi asam basa. Pada percobaan ini aspirin komersil masih mengadung asam salisilat sedangkan kandungannya adalah 66,15 % yang berarti telah memenuhi kadar kelayakan aspirin dalam sediaan farmasi oral menurut standar FDA.
Pendahuluan
Latar Belakang
Sifat antipiretik dan analgesik yang ditemukan berasal dari senyawa salicin. salicin merupakan kelompok glikosida. Glikosida adalah senyawa yang memiliki bagian gula terikat pada non-glikosa L.
Aglikon dalam salian adalah salial alkohol dan tereduksi sempurna menjadi asam salisilat. Asam salisilat sangat keras terhadap bibir kerongkongan dan perut, sehingga kimiawan felix Hoffmann yang awalnya terinspirasi oleh sakit artritis yang

diderita ayahnya, mensintesis asam asetil salisilat yang dinamakan aspirin yang ringan terhadap perut. Dengan senyawa ini Hoffmann dapat mengobati ayahnya tanpa mengakibatkan iritasi perut yang parah seperti efek samping obat artritis pada masa itu. Itulah salah satu fungsi aspirin yang dicobakan pada praktikum.
indikasi aspirin adalah untuk meringankan rasa sakit, terutama sakit kepala dan pusing, sakit gigi, dan nyeri otot serta menurunkan demam.
Tujuan Praktikum
Praktikum ini bertujuan untuk :
1. Mensintesis aspirin dari asam salisilat.
2. menentukan persen rendemen hasil sintesis
3. Menguji keberadaan asam salisilat
4. menentukan kadar aspirin dalam suatu senyawa menggunakan metode asam basa
5. Menentukan titik leleh asam salisilat
6. Menentukan titik leleh kristal aspirin dari hasil praktikum.
Teori Dasar
Aspirin dibuat dengan mereaksikan asam salisilat dengan anhidrida asam asetat menggunakan katalis 85% H3PO4 sebagai zat penghidrasi. Asam salisilat adalah asam bifungsional yang mengandung dua gugus –OH dan –COOH. Karenanya asam salisilat ini dapat mengalami dua jenis reaksi yang berbeda yaitu reaksi asam dan basa. Reaksi dengan anhidrida asam asetat akan menghasilkan aspirin.


Sedangkan reaksi dengan methanol akan menghasilkan metil salisilat
Uji terhadap asam salisilat, ”my aspirin”, dan aspirin komersil digunakan untuk menguji kemurnian aspirin, khususnya mendeteksi apakah masih terdapat asam salisilat dalam sampel. Kemurnian aspirin bisa diuiji dengan menggunakan besi(III) klorida. Besi(III) klorida bereaksi dengan gugus fenol membentuk kompleks ungu. Asam salisilat (murni) akan berubah menjadi ungu jika FeCl3 ditambahkan, karena asam salisilat mempunyai gugus fenol, seperti terlihat pada gambar.
Selain itu kemurnian aspirin juga dapat ditentukan dengan uji titik leleh, dimana seharusnya titik leleh aspirin murni adalah 136 oC . Persen rendemen dapat dihitung dengan :
Sedangkan untuk kandungan analisis aspirin dapat digunakan titrasi asam basa menggunakan NaOH setelah Kristal aspirin dilarutkan dalam etanol (pelarut organik)
Metodologi
Alat
Penangas air, erlenmeyer 125 ml, batang pengaduk, klem, corong buchner, tabung reaksi, tabung kapiler, melting blok, bunsen, termometer, buret.
Bahan
1,4 g asam asetil salisilat, anhidrida asetat, asam phosphat 85%, aqua dm, etanol, FeCl3, fenolftalein, tablet aspirin, NaOH 0,1 M.
Cara Kerja
Sintesis Aspirin
Sebanyak 1,4 g asam salisilat dimasukan kedalam erlenmeyer 125 ml. Lalu ditambahkan 4 ml anhidrida asetat sambil dibilas. Ditambahkan juga H3PO4 85% sebanyak 5 tetes, setelah itu dipanaskan. Setelah 5 menit diangkat dan ditambahkan 2 ml aqua dm. Ditunggu selama 3 menit, setelah itu ditambah lagi 20 ml aqua dm. Dibiarkan hingga mengkristal, bila tidak mengkristal dapat dilakukan penggoresan dinding dengan batang pengaduk. Ditambahkan 50 ml aqua dm dingin. Ditunggu hingga terbentuk kristal bila sudah terbentuk dimasukkan ke corong buchner lalu dipisahkan. Setelah itu dilakukan rekristalisasi. Ditambah 5 ml etanol dan 20 ml air hangat. Dipanaskan dan ditunggu hingga semua larut lalu dsaring dengan corong buchneer. Setelah didapat kristal lalu ditimbang dan dihitung rendemen.
Uji terhadap aspirin
Disiapkan 3 tabung reaksi yang sudah diberi anama asam salisilat, my aspirin, dan komersial aspirin. Dimasukkan masing – masing zat seperti yang sudah ada label. Setelah itu ditambah 20 tetes aqua dm sanbil digoyang. Setelah itu ditambah 10 tetes FeCl3 10%, diamati perubahan warna yang terjadi.
Penentuan titik leleh
Disiapkan 2 tabung kapiler, lalu di issi dengan sampel aspirin dan hasil sintesis. Dipasang melting blok dan termometer distatif. Dimasukkan juga pipa kapiler yang sudah diisi ke melting blok. Dipanaskan dengan bunsen. Diamati trayek titik lelehnya.
Analisis kandungan aspirin
Dimasukkan 2 tablet aspirin ke erlenmeyer 125 ml, sebelumnya dihancurkan hingga terlihat seperti bubuk terlebih dahulu. Dimasukkan 10 ml etanol dan 3 tetes fenolftalein, serta aqua dm hingga 50 ml. dititrasi dengan NaOH 0,1 ml hingga berubah warna. Dicatat volumenya lalu dihitung berapa masa asetil salisilat, menurut literatur kekuatan asam asetil salisilat minimal 5 grains (1 grains = 0,0648 g).
Data Pengamatan
Sintesis Aspirin
Kristal asam salisilat berwarna putih. Larutan yang dibentuk dari asam salisilat dengan anhidrida asam asetat dan 5 tetes larutan 85% H3PO4 keruh. Setelah 5 menit dipanaskan, larutan berubah menjadi bening. Kemudian ditambahkan air ke dalam larutan sehingga larutan menjadi keruh kembali, namun setelah beberapa lama, terbentuk kristal putih. Kristal ini dilarutkan dengan etanol dan direkristalisasi.
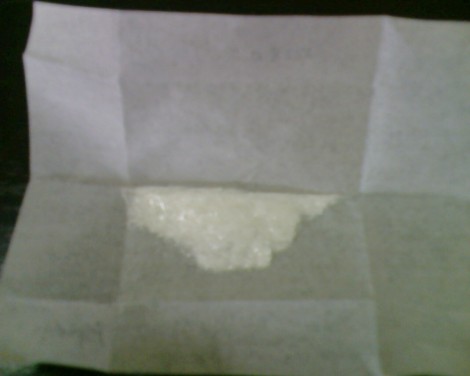
Kristal aspirin
Didapat kristal berwarna putih berbentuk jarum yang bermassa 0.8225 gram.
Uji terhadap aspirin
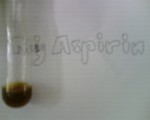 “my aspirin” aspirin komersil asam salisilat
“my aspirin” aspirin komersil asam salisilat
setelah ditetesi FeCl3 larutan memberikan warna yang berbeda-beda pada tabung. Tabung “my aspirin” memberikan warna orange muda, tabung aspirin komersil memberikan warna orange keunguan, sedangkan asam salisilat memberikan warna ungu.
Penentuan titik leleh
Titik leleh asam salisilat adalah 150-156 C dan titik leleh “my aspirin” adalah 120-124 C.
Analisis kandungan aspirin

Pada analisis kadar aspirin menggunakan tritasi asam basa dengan sampel larutan tablet aspirin 0,2 gram, dan NaOH 0.098 N sebagai peniter, NaOH yang digunakan adalah 7.5 ml.
Perhitungan
Sintesis Aspirin
Massa asam salisilat : 1.4 gram,
Maka, mol asam salisilat =
Persamaan reaksi :
Mol aspirin sama dengan mol asam salisilat
Jadi massa aspirin = mol aspirin Mr aspirin = 0.010145 mol 180
= 1.8261 gram
Persen rendemen dapat dihitung dengan menggunakan persamaan:
Jumlah mol NaOH yang bereaksi = 0,098 M x 7.5 mL = 0.735 mmol
Persamaan reaksi :
0.735 mmol 0.735 mmol
Massa aspirin dalam sampel
= 0.735 180 = 132.3 mg
Massa tablet yang digunakan adalah 0,2 gram, maka kadar aspirin dalam tablet
= (132,3 mg)/(200 mg) x 100 %=66,15 %
Pembahasan
Sintesis Aspirin
Pada pembuatan aspirin terjadi reaksi sebagai berikut :
H3PO4 yang ditambahkan, digunakan sebagai katalis, reaksi ini juga dilakukan pada air yang dipanaskan agar mempercepat tercapainya energi aktivasi. Sedangkan pendinginan dimaksudkan untuk membentuk kristal, karena ketika suhu dingin, molekul-molekul aspirin dalam larutan akan bergerak melambat dan pada akhirnya
terkumpul membentuk endapan melalui proses nukleasi (induced nucleation) dan pertumbuhan partikel
mekanismenya adalah sebagai berikut :
Anhidrida asetat menyerang H+
Anhidrida asam asetat mengalami resonansi
anhidrida asam asetat menyerang gugus fenol dari asam salisilat
H+ terlepas dari –OH dan berikatan dengan atom O pada anhidrida asam asetat
anhidrida asam asetat terputus menjadi asam asetat dan asam asetilsalisilat (aspirin)
H+ akan lepas dari aspirin
Rendemen hasil praktikum ini , hal ini terjadi karena banyaknya Kristal yang menempel di alat-alat sintesis seperti corong Buchner, gelas kimia dan sebagainya.
Uji Terhadap Aspirin
Fenol yang bereaksi dengan FeCl3 akan memberikan warna ungu, karena asam salisilat adalah senyawa yang mengandung Fenol maka reaksi FeCl3 dengan asam salisilat juga akan memberikan warna ungu.
Dari percobaan diproleh bahwa
Asam salisilat + FeCl3 berwarna ungu, terbukti bahwa asam salisilat mengandung fenol
Dari literatur dapat dilihat bahwa asam salisilat memang mempunyai gugus fenol
Reaksi antara ”my aspirin” dengan FeCl3 memberikan warna orange muda, berarti dalam aspirin tidak lagi mengandung asam salisilat.
Reaksi antara aspirin komersil dengan FeCl3 memberikan warna orange gelap dengan sedikit keunguan, berarti hanya mengandung sedikit sekali asam salisilat.
Penentuan Titik Leleh Asam Salisilat dan Aspirin
Berdasarkan literatur, titik leleh asam salisilat adalah 159 oC, dari hasil percobaan diperoleh titik leleh asam salisilat 150-156 C, hasil ini tergolong sesuai, sedikit berbeda dengan literatur karena ketidaktelitian pengukuran titik leleh.
Titik leleh ”my aspirin” hasil percobaan 120-124 C. Berdasarkan literatur, titik leleh aspirin adalah 136 oC. Berbeda dengan literatur karena masih adanya sedikit pengotor pada kristal aspirin.
Analisis Kandungan Aspirin dalam Tablet Aspirin Komersial
kadar aspirin dalam tablet = 66,15 %
terdapat reaksi sabagai berikut,
sampai pada akhirnya semua aspirin telah bereaksi dan terdapat NaOH yang memberikan warna merah muda ketika bereaksi dengan indikator fenolftalein.
Aspirin yang terkandung dalam 0,2 g sample adalah 132,3 mg. Jika dikonversikan ke dalam 0,5 g (standard satu tablet) akan didapatkan massa aspirin sebesar 330 mg. Standar kelayakan berdasarkan FDA adalah minimal 5 grains asam asetil salisilat dalam 1 tablet (1 grains = 0,0648 g). berarti minimal harus terdapat 0,324 g asam asetil alisilat dalam 1 tablet. Jadi berdasarkan uji ini, kandungan aspirin dalam tablet memenuhi standar FDA.
Simpulan
Berdasarkan pemaparan di atas, dapat disimpulkan :
Persentase rendemen hasil sintesis aspirin adalah 66,15 %
”my aspirin” tidak mengandung asam salisilat, sedangkan dalam aspirin komersil masih terdapat sedikit asam salisilat
Aspirin adalah kristal putih berbentuk jarum dengan trayek titik leleh 120-124
Asam salisilat berbentuk kristal putih serbuk dengan trayek titik leleh 150-156 C
kadar aspirin dalam tablet = 66,15 %, kadar ini memenuhi standar FDA
Daftar Pustaka
Furniss, Brian S., et al., Vogel’s Textbook of Practical Organic Chemistry 5th Edition-Revised. 1989. Longman Scientific & Technical, Essex, England. (page 135 -151, 236-240).
Gusdinar, Dr. Tutus, slide kuliah analisis gravimetri.2008. Sekolah Farmasi Institut Teknologi Bandung, Bandung (page 20-21)
http://farmasi.unlam.ac.id/pendidikan/GBPP/Kimia%20organik%202%20GBPP.pdf (diakses tanggal 16 Desember 2008)
Dr. Ritmaleni, mengenal lebih dekat
prekursor narkoba.2008. Fakultas
Farmasi UGM, Jogjakarta
(halaman : 6)
euleuh euleuh…
laporan KO naha aya di dieu?
ck..ck..
le le, aneh2 kwe ki. gak enek ide laen opo.
opo males ngetik..
maen pingpöng wae yo!!
syukran mas u artikelnya…
ana lg nyari tugas sintesis senyawa organik dr kmpuz dan ana dapat tulisan antum,,,
jazakallah khair..
alhamdulillah..
sekarang giliran nayang praktikum beginian.
thx yow…
waaaa sng , pas ada tugas ttg sintesis aspirin tnyta ada disinii . maakssiiii yahhh .
🙂
boleh nanya, sampeyan semester berapa? udah pernah nelakuin penelitian, apa aja? bagi-bagi dong ilmunya. jazakallah ….
boleh nanya, sampeyan semester berapa? udah pernah ngelakuin penelitian, apa aja? bagi-bagi dong ilmunya. jazakallah ….
@ semua
syukur kalo bermanfaat..dulunya sih masukin materi ini karena lagi sibuk akademik N gk ada waktu nulis eh malah berguna
@ rina liyaningsih
kulo semester 4 mbak,,penelitian?? waah mending belajar dulu sekarang…Farmasi ITB melelahkan.
paling cuma ikut2 penelitian kaya buat PKM gitu mbak
assalamualaikum wr.wb. mo tanya donk, tentang isolasi hesperidin dari kulit jeruk, bagaimana proses dan reaksinya.
waalaikumussalam…wah saya bukan dosen..gak semua tahu..tapi saya jawab sebisa saya ya…sepengetahuan hesperidin adalah salah satu jenis Flavonoids yang terdapat pada Rutaceae seperti jeruk, lemon dsb..
Banyak cara untuk memperolehnya
1. Destilasi (penyulingan)
a. hydro destillation -> caranya : serbuk simplisia dicampur dengan aquades kemudian didestilasi
b. water-steam distillation -> caranya : daun diletakkan diatas air, kemudian dididihkan
c. destilasi uap
2. Penarikan dengan molekul pelarut organik mudah menguap (non polar)
caranya : simplisia di ekstraksi + pelarut polar -> ekstrak, dipekatkan ->masa semisolid, diekstraksi ulang + etanol,dinginkan disaring -> ada dua fraksi yaitu fraksi residu (semisolid) dan fraksi etanol, fraksi etanol inilah yang ,mengandung hesperidin
selain itu ada cara lain seperti ekstraksi dengan lemak padat, maserasi, superkritikal dengan CO2 (kepanjangan klo dijelasin juga)
coba anda cari di bukunya tyler : Pharmacognosy, Brunetton, atau Samuelsson…klo mau cari di website mending ke web site berbahasa inggris…artikel2 berbahasa Indonesia memang masih terbatas…
wallahua’lam…
Eh,tau ga,pas praktikum DSSO,bagian reaksi esterifikasi,blogmu bnyk jadi sumber lho.. Hayyah.. Aku langsung mengenali gtu alamat webnya..
biasa aja teh, gak usah kagum gitu…=P
assalamu’alaykum wr.wb.
jazakallah akh, bermanfaat, tapi ane akan update lagi dengan modifikasi dari ilmu yang ane dapat, so makin berkembang, gak hanya seperti yang antum tulis.
akhmar_unair kimia surabaya 2007
salam kenal.
wassalamu’alaykum wr.wb
terima kasih. sangat berguna untuk tugas KO saya. Kalau boleh tau, kuliah dimana? sisntesis aspirin sangat membantu. saya tunggu yang asetanilida… hehehehe.
Asslkm………….
afwan …ana mw ijin ngopi sistesis aspirin…. utk tgs mata kul. sintesis senyawa organik………….bingung euy carinya….
thanks yah…
tulisanya sangat membantu…
assalamualaikum..
terimakasih berkat artikel ini tugas laporan saya jadi kelar..
makasi banyaak, benar2 berguna… 😀
artikelnya saya jadikan referensi.
salam kenal, saya juga anak ITB, kimia 2008.. 🙂
waalaikumussalam…^^….saya juga kenal beberapa anak kimia 08..ada fitri, ali, dll..salam kenal juga
Ass..
mksh akh, artikelnya membantu sy dlm mnambah dsar teori praktikum KO..
zlam knal+zlam ukhuwah ja..
dr ank pend.kimia’08 UNNES..
🙂
Assalamu’alaikum,,,k wahyu,,,laporannya kenapa taro di sini?? pinjem bwt bikin laporan y,,,jadi referansi,,,makasih,,
iya hahaha..ini tu karena BT sama farmasi yang kebanyakan praktikum, jadinya gak bisa nulis…ya udah masukin aja laporan2 praktikum..
@manda:mandaaa,gw juga ngambil dari siniiii…
@ ka wahyu: ka skalian mau ijin juga,tadi ‘nyontek’ tujuan,sama cara ngitung yang titrasi itu lhooo,tapi punyaku agak aneh gtu..
berat per tablet 0,2 yah ka?? kelompok akau ga ngitung gtu,hwaa..
oia,sama yang uji ungu2 juga punya kk jadi ilham gtu bwd laporanku,hehe…
makasih ka wahyuuuuuu…
oooo,,,hehehe,,ternyata merasakan hal yang sama juga,,,makasih y k,,,
mksi bgt bwt k wahyu =D sering2 ya kak taruh laporan dsni. hehe. biar nyari referensiny g ribet2 bgt. hehe
btw, kristal hasil sintesis yang “my aspirin” tu puny kkak pas diuji FeCl3 wrnany oren ya bkan ungu? wew… hebat, puny klmpokq wktu dites masi ungu tua T.T msi ad as.salisilatnya. gagal deh bikin aspirinny T.T
boleh tidak kalo asetat anhidrida nya diganti dengan senyawa lain?makasi tolong dibales secepatnya ya…makasi….
kan intinya kita akan mensubtitusi H+ dari gugus OH pada asam salisilat dengan gugus CH3 CO, jadi harus pereaksi harus mengandung gugus CH3COO, nah reagen yang mudah putus ketika bereaksi dengan air kemudian mensubtitusi H+ dari gugus OH adalah anhidrida asetat ini, selain itu produk sampingnya juga tidak berbahaya atau mengganggu karena hanya berupa asam asetat..yang saya tahu sintesis aspirin yang ada hanya menggunakan anhidrida asetat..tapi mungkin saja ada senyawa lain yang bisa memberikan gugus asetilnya kepada asam salisilat. coba cari aja
kenapa sintesisnya pada dilakukan pada suhu 60 C?
yang saya tahu biar larut aja reagennya ^_^
waktu tes kimia, aspirin di tetesi langsung dengan FeCl3 gimana? reaksinya lbh cepat atw lambat??
karena kami pakai metode itu.
maksudnya lebih cepat atau lebih lambat gimana?? FeCl3 kan buat nguji apakah dalam aspirin yang kita buat masih terdapat kontaminan (dalam hal ini pereaksi asam salisilat)
diuji setelah aspirin terbentuk
Apakah reaksi antar asam salisilat dan anhidirida asetat reaksi bolak-balik? artinya yang sudah menjadi asetaosal dapat kembali lagi menajdi asam salisilat?,
Asetosal apakah mudah terurai? dalam kondisi apa dia mudah terurai ? trims
Ping-balik: sintesis aspirin « Egyitb's Blog·
izin copas bwt laporan,,tengkyu,,
punten ijin dijadiin referensi buat pembahasan ya.
kristalnya bagus ya… yang saya jelek banget. buchnernya ga beres. kristalnya masih basah-basah gitu. jelek banget lah titik lelehnya… -_-‘
yang sering muncul di daftar pustaka laporan KO anak-anak farmasi 2009:
blog ka wahyu sama blognya ka yudha.. hahha..
makasih ka buat referensinya… 😀
kok ga ada sitasinya yah…. hmm…..
itu udah ada daftar pustakanya mbak ayu, ini laporan praktikum, bukan jurnal ilmiah -_-
makasih bwat artikelnya kk wahyu.. membantu banget .. tugas ko aku tentang sintesis aspirin ,, udah kelar jga:)
thanks berat, sangat membantu tugas KO saya. ^^
alhamdulillah, asal ga copas saja, tp dipahami jg..